
STRUTTURA DEL GRAFENE
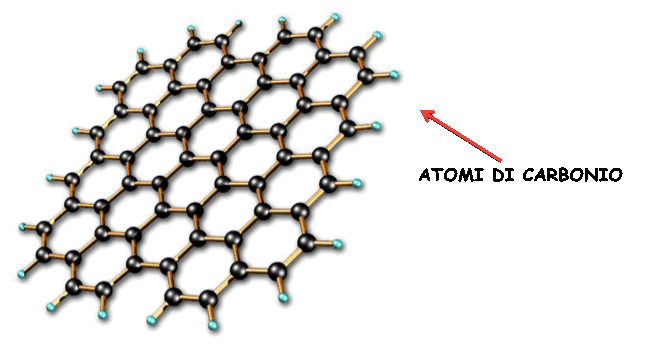 Il
GRAFENE presenta una struttura
cristallina
(distribuzione
regolare e ripetitiva di atomi) a
celle esagonali,
come illustrato in figura. Nella struttura del grafene gli atomi di
carbonio sono ibridizzati
nella forma sp2;
questo
tipo di ibridizzazione consente agli atomi di carbonio di legarsi in
modo tale da formare un cristallo
del
tutto bidimensionale;
la
lunghezza del legame “C-C” e' pari a 0,142 nm.
Il
GRAFENE presenta una struttura
cristallina
(distribuzione
regolare e ripetitiva di atomi) a
celle esagonali,
come illustrato in figura. Nella struttura del grafene gli atomi di
carbonio sono ibridizzati
nella forma sp2;
questo
tipo di ibridizzazione consente agli atomi di carbonio di legarsi in
modo tale da formare un cristallo
del
tutto bidimensionale;
la
lunghezza del legame “C-C” e' pari a 0,142 nm.
IBRIDIZZAZIONE DEGLI ORBITALI DEL CARBONIO
L'ibridizzazione (o ibridazione) puo' essere definita come un processo nel quale un certo numero di orbitali atomici (s, p, d) di uno stesso atomo si combinano tra loro. Gli orbitali atomici, coinvolti nel processo di ibridazione, hanno un contenuto energetico leggermente diverso (orbitali di valenza). La combinazione di diversi orbitali atomici permette di ottenere nuovi orbitali atomici ibridi equivalenti (isoenergetici), con lobi orientati lungo le direzioni dei possibili legami che un atomo puo' formare con altri atomi.
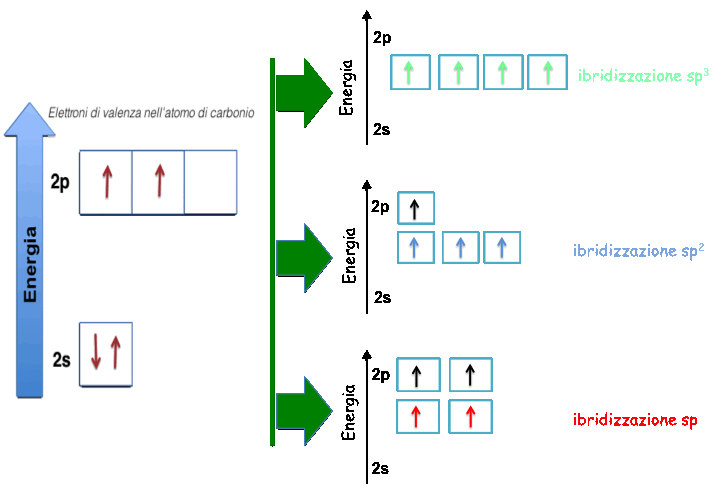
Per spiegare il fenomeno dell'ibridizzazione e' necessario far riferimento alla configurazione elettronica che in questo caso coinvolge l'atomo di carbonio. Un atomo di carbonio possiede sei protoni e sei elettroni, due elettroni occupano l'orbitale atomico “1s” e sono molto legati; invece due degli altri quattro elettroni (elettroni di valenza, che si trovano nel secondo livello energetico) occupano l'orbitale atomico “2s” e sono accoppiati; gli altri due elettroni sono spaiati ed occupano differenti orbitali atomici “2p”. Quindi, la configurazione elettronica dell'atomo di carbonio puo' essere riscritta nella forma: 1s22s22px2py.
Gli orbitali atomici 2s e 2p dell'atomo di carbonio hanno energie molto simili, percio' gli elettroni che li occupano possono muoversi tra di essi molto facilmente, generando cosi' il fenomeno dell'ibridizzazione.
La figura mostra le rappresentazioni schematiche degli elettroni di valenza nei tre tipi di ibridizzazione dell'atomo di carbonio; ognuna corrisponde ad una diversa combinazione degli orbitali atomici del secondo livello energetico. L'esponente della lettera “p” indica il numero di orbitali atomici di “tipo p” che partecipano alla formazione dell'ibrido:
IBRIDIZZAZIONE SP2
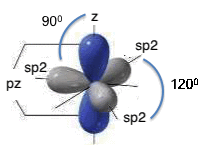
Nel caso particolare dell'ibridizzazione sp2 si ha il “mescolamento” dell'orbitale atomico 2s con due orbitali atomici 2p (2px e 2py); il risultato e' la formazione di tre orbitali atomici ibridi detti orbitali sp2. Questi orbitali atomici sono isoenergetici, perfettamente equivalenti, orientati simmetricamente in un piano; essi formano angoli di 120° ed originano la cosiddetta struttura triangolare planare; il quarto orbitale atomico, “pz”, non coinvolto nell'ibridazione, pone i lobi perpendicolarmente al piano su cui si trovano i tre orbitali atomici ibridi sp2:
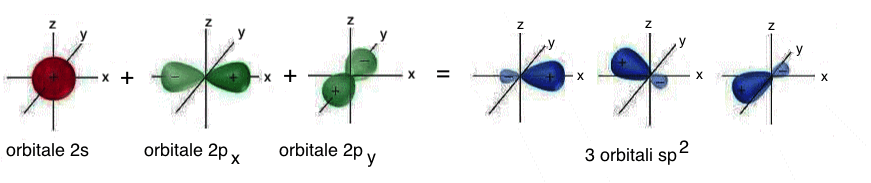 Rappresentazione
grafica degli orbitali
atomici ibridi
sp2.
Rappresentazione
grafica degli orbitali
atomici ibridi
sp2.
 Ibridizzazione
sp2.
Ibridizzazione
sp2.
Quando due atomi di carbonio, ibridizzati sp2, si accostano, viene a formarsi un forte legame σ per sovrapposizione degli orbitali atomici ibridi “sp2 – sp2”; in questo caso anche gli orbitali atomici p, non ibridizzati ma ancora presenti in ciascun atomo di carbonio, si avvicinano tanto da sovrapporsi e formare un legame π, come si puo' vedere dalla figura che segue:
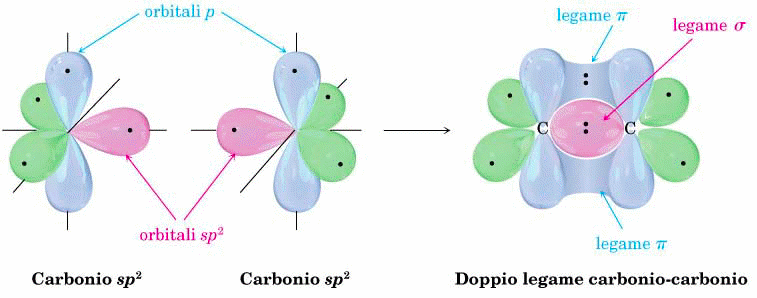
In ibridazione sp2 quindi ogni atomo ha a disposizione tre legami σ sul piano x-y, con i quali esso puo' formare un reticolo a nido d'ape; in questo reticolo gli orbitali atomici pz si uniscono in un legame π localizzato sopra e sotto il piano x-y. Questo e' il caso della grafite, dove tanti reticoli bidimensionali a nido d'ape sono tenuti insieme, uno sull'altro, tramite una debole interazione di Van der Waals.
Il legame formato dagli orbitali atomici sp2 e' quello che origina le nanostrutture: fullereni, nanotubi e grafene.
IBRIDIZZAZIONE SP3
Nel caso del diamante, ogni atomo e' legato ad altri quattro atomi, disposti ai vertici di un tetraedro; in questo caso si parla di ibridizzazione sp3:
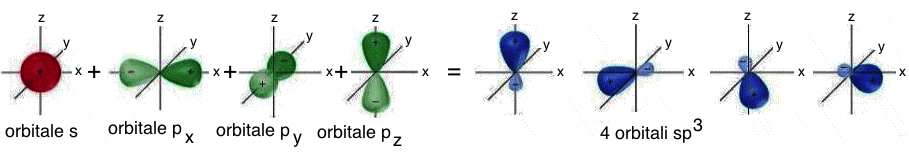 Rappresentazione
grafica degli orbitali
atomici ibridi
sp3
Rappresentazione
grafica degli orbitali
atomici ibridi
sp3
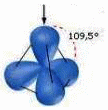 Ibridizzazione
sp3.
Ibridizzazione
sp3.
Nell'ibridizzazione sp3 si ha il “mescolamento” dell'orbitale atomico 2s con i tre orbitali atomici 2p. Il risultato e' la formazione di quattro orbitali atomici ibridi isoenergetici, perfettamente equivalenti, orientati simmetricamente nello spazio; essi formano angoli di 109,5° dando luogo alla struttura tetraedrica.
IBRIDIZZAZIONE SP
La combinazione di un orbitale atomico di tipo s con un orbitale atomico di tipo p produce due orbitali atomici ibridi di tipo sp. Nell'ibridizzazione sp, i due orbitali atomici ibridi isoenergetici e perfettamente equivalenti, che si generano, sono orientati simmetricamente su una linea, in modo da formare un angolo di 180° (struttura lineare). I due orbitali atomici di tipo p, non coinvolti nell'ibridazione, si dispongono invece su piani perpendicolari tra loro e perpendicolari alla linea su cui si trovano i due orbitali atomici ibridi di tipo sp:
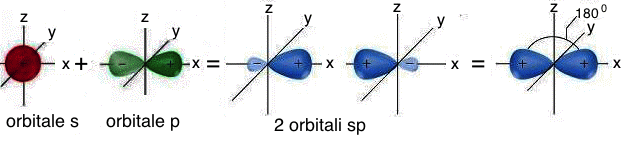 Rappresentazione
grafica degli orbitali atomici ibridi sp.
Rappresentazione
grafica degli orbitali atomici ibridi sp.
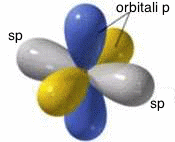 Ibridizzazione
sp.
Ibridizzazione
sp.
In ciascun tipo di ibridizzazione, il lobo di dimensione maggiore dell'orbitale atomico e' quello che interviene nei legami con altri atomi; per questo motivo, nelle figure che rappresentano i diversi tipi di ibridizzazione, e' stato omesso, per semplicita', il lobo di dimensioni inferiori.